
É constituído
por neutrons e prótons. O neutron não tem carga elétrica. O próton
tem carga elétrica positiva, que se representa por
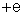 . Representa-se por Z o número de prótons de um átomo. A carga
positiva do núcleo é então
. Representa-se por Z o número de prótons de um átomo. A carga
positiva do núcleo é então
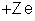 .
.
Possuem carga
elétrica negativa, de mesmo valor absoluto que a dos prótons, e que se
representa por
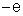 . Como o átomo é neutro, concluímos que o número de elétrons é
igual ao de prótons. Há Z prótons, cuja carga total é
. Como o átomo é neutro, concluímos que o número de elétrons é
igual ao de prótons. Há Z prótons, cuja carga total é
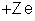 , e Z elétrons, cuja carga total é
, e Z elétrons, cuja carga total é
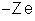 . A carga total do átomo é nula.
. A carga total do átomo é nula.
Os elétrons
giram ao redor do núcleo dispostos em várias órbitas. A distância dos
elétrons ao núcleo é muito grande, relativamente ao tamanho do núcleo.
Por isso se diz que o átomo parece um sistema solar em miniatura.
As órbitas dos
elétrons são representadas, de dentro para fora, pelas letras K, L, M,
N, O, P, Q. A órbita K é a mais interna, Q é a mais externa. A
distribuição dos elétrons nessas órbitas é conhecida para cada
elemento (nos referimos aqui a elemento químico, como por exemplo,
hidrogênio, ouro, urânio, etc.). Para cada órbita há um número máximo
de elétrons admissível, que nunca é ultrapassado, em nenhum elemento.
Êsses números figuram na tabela abaixo:
|
Órbita
|
Número máximo de elétrons
|
|
K
L
M
N
O
P
Q |
2
8
18
32
32
1
8
|
O átomo de
hidrogênio tem o núcleo constituído por um único próton. E tem
somente um elétron, na única órbita, K.
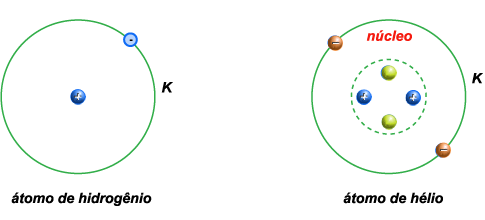
2 – O átomo de
hélio tem o núcleo constituído por dois prótons e dois neutrons. E
tem dois elétrons, na única órbita, K.
3 – O átomo de
lítio tem o núcleo constituído por três prótons e quatro neutrons.
Tem três elétrons: dois na órbita K, um na L.
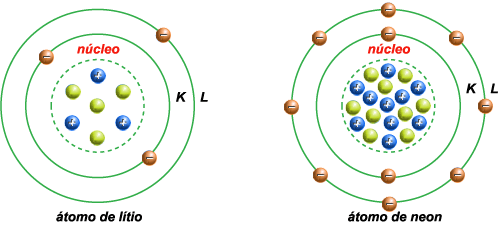
4 – O átomo de
neon tem o núcleo constituído por dez prótons e nove neutrons. Tem
dez elétrons: dois na órbita K, e oito na L.
5 – O átomo de
sódio tem o núcleo constituído por onze prótons e dez neutrons. Tem
onze elétrons: dois na órbita K, oito na L, um na M.
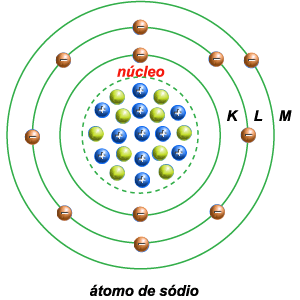
6 – O átomo de
urânio, o maior que existe na natureza, tem o núcleo formado por 92
prótons e 146 neutrons. Tem 92 elétrons, dispostos do seguinte modo:
2 na órbita K, 8 na L, 18 na M, 32 na N, 18 na O, 12 na P, 2 na Q.
A estrutura do
átomo como a conhecemos hoje, com os elétrons girando ao redor de um
núcleo positivo, é chamada estrutura de Rutherford-Bohr. Isso
porque, Ernest Rutherford, grande físico experimental, realizou uma
experiência decisiva, mostrando que a estrutura do átomo só pode ser
essa. E Niels Bohr, grande físico teórico, ainda vivo, foi o
primeiro a tentar uma exposição matemática dessa estrutura.